Qualitätsaspekte bei Varroa-Präparaten
Grundlage für die Qualitätskontrolle
Die Rechtsverordnung über Standardzulassungen regelt:
- Herstellungsvorschrift
- Inprozess-Kontrollen
- Eigenschaften & Prüfungen:
- Ausgangsstoffe
- Fertigarzneimittel
- Aussehen, Eigenschaften
- Prüfung auf Identität
- Gehalt
- Haltbarkeit
Kurzbeschreibung
Varroa-Präperate auf Basis organischer Säure
Ameisensäure 60% ad us. vet.
Zulassungsnummer: 2469.99.99
Zum Verdunsten mit Hilfe eines geeigneten Applikators
Frei verkäuflich

Milchsäure 15% ad us. vet.
Zulassungsnummer: 2569.99.99
Zur Sprühanwendung im Bienenstock
Frei verkäuflich

Oxalsäuredihydrat – Lösung 3,5% ad us. vet.
Zulassungsnummer: 2669.99.99
Oxalsäuredihydrat – Lösung und Saccharose – Pulver zum Mischen vor dem Gebrauch
Apothekenpflichtig
Standardzulassungen?!
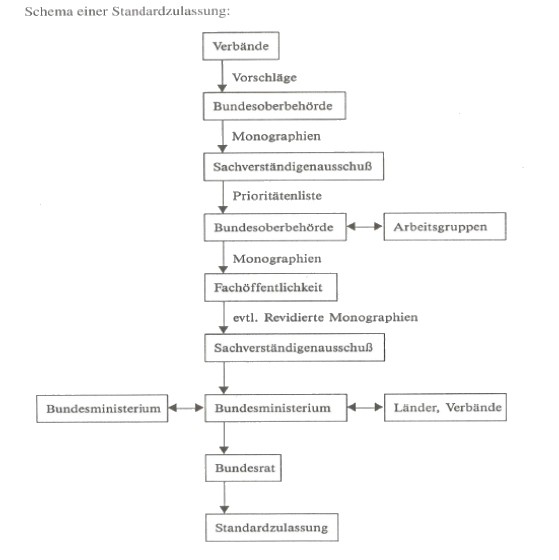
Seit 1976 gibt es die Möglichkeit, dass bestimmte Fertigarzneimittel gemäß § 36 AMG auf Grund von Standardzulassungen von der Zulassungspflicht freigestellt werden.
Voraussetzung hierfür ist, dass keine Gefährdung von Mensch und Tier zu befürchten ist. Standardzulassungen basieren auf Monographien, die das Bundesministerium für Gesundheit in Kraft setzt. Bei den aktuell gültigen Standardzulassungen reicht das Spektrum der arzneilich wirksamen Bestandteile von chemisch definierten Substanzen, wie z.B. Paracetamol, bis hin zu arzneilich wirksamen Tees.
Werdegang einer Standardzulassungen(22 Personen)
Sachverständigen-Ausschuss für Standardzulassungen
- drei Hochschullehrer der Pharmakologie, davon ein Hochschullehrer des Faches Veterinärmedizin,
- zwei Hochschullehrer der Pharmazie,
- ein Vertreter der Deutschen Krankenhausgesellschaft,
- ein Vertreter der Krankenhausapotheker,
- ein Vertreter der Arzneimittelkommission der Deutschen Ärzteschaft,
- ein Arzt für Allgemeinmedizin,
- ein Zahnarzt,
- ein Tierarzt,
- ein Heilpraktiker,
- drei Vertreter der Pharmazeutischen Industrie, davon ein Vertreter der veterinärpharmazeutischen Industrie,
- ein Vertreter der Apothekerschaft,
- ein Vertreter der Reformwaren-Hersteller,
- ein Vertreter des Einzelhandels außerhalb der Apotheken,
- ein Vertreter der Arbeitsgemeinschaft der Verbraucher,
- ein Vertreter der Gewerkschaften und
- zwei Vertreter der Sozialversicherungsträger
Inhalt einer Standardzulassung
- Bezeichnung des Fertigarzneimittels
- Darreichungsform
- Zusammensetzung
- Herstellungsvorschrift
- Inprozess-kontrollen
- Eigenschaften und Prüfungen
- Behältnisse
- Kennzeichnung
- Packungsbeilage
- Fachinformation
Qualität in Herstellung und Prüfung
Der Ausgangsstoff z.B. Milchsäure (Ph. Eur.)
- Qualifizierter Lieferant (Audit, Lieferantenbewertung)
- Wissen über Herstellungsverfahren (Fermentation oder chemische Synthese)
- Wissen über Verunreinigungsspektrum (Mannitol, Glycerol, Gummi, Kohlenhydrate, Methanol, Citronen-, Oxal- und Phosphorsäure, Sulfat, Calcium)
Der Herstellungsprozess
- Qualifizierte Räume und Ausrüstungsgegenstände
- Validierte Herstellungsverfahren
- Qualifiziertes, geschultes Personal
Die Analytik
- Qualifizierte Prüfmittel
- Validierte Prüfverfahren
- Qualifiziertes, geschultes Personal
Das Packmittel
- Zertifizierte Sicherheit und Unbedenklichkeit (Leachables & Extractables)
- Laufende Stabilitätsuntersuchungen
Qualitätssicherung
Herstellungsvorschrift und Inprozess-Kontrollen
Ameisensäure 60% ad us.vet.
39,55g gereinigtes Wasser +
60,45g Ameisensäure 98%
mischen
abfüllen
Relative Dichte bestimmen
(1,142 – 1,145)
AB.2.2.5
Milchsäure 15% ad us.vet.
83,33g gereinigtes Wasser +
16,67g Milchsäure 90%
mischen
abfüllen
Relative Dichte bestimmen
(1,034 – 1,036)
AB.2.2.5
Oxalsäuredihydrat- Lösung 3,5% (m/V) ad us.vet.
Menge an Oxalsäuredihydrat für eine Charge in entsprechender Menge Wasser lösen und abfüllen
Menge an Saccharose für eine Charge in packungsgerechte Beutel füllen und luftdicht verpacken
Gleichförmigkeit der Masse einzeldosierter Arzneiformen
AB. 2.9.5.
Ausgangsstoffe sowie Aussehen und Eigenschaften
Ameisensäure 60% ad us.vet.
Ameisensäure 98% (m/m) entspr. Monografie des Deutschen Arzneimittel – Codex (DAC)
Klare, farblose, flüchtige, stark ätzende Flüssigkeit
Stechender Geruch
Milchsäure 15% ad us.vet.
Milchsäure 90% (m/m) (hiervon ca. 90% als L(+) – Enantiomer
Klare, farblose Flüssigkeit
Oxalsäuredihydrat- Lösung 3,5% (m/V) ad us.vet.
Oxalsäuredihydrat (HAB) Saccharose (Ph. Eur.) Wasser, gereinigt (Ph. Eur.)
Klare, farblose Flüssigkeit
Gebrauchsfertige Lösung: relative Dichte 1,236g/m³ (20°C)
Prüfung auf Identität und Gehalt
Ameisensäure 60% ad us.vet.
Farbreaktion (rote Färbung)
Titration mit NaOH- Lösung nach Zusatz von Phenolphthalein bis zur Rosafärbung
1ml NaOH = 46,03mg CH2O2
Soll: 59,0 – 61,0% (m/m)
Milchsäure 15% ad us.vet.
Identitätsprüfung auf Lactat
AB.2.3.1.
Titration mit Salzsäure nach Zusatz mit NaOH- Lösung und Phenolphthalein bis zum Verschwinden der Rosafärbung
1ml NaOH = 90,1mg C3H6O3
Soll: 14,0 – 16,0% (m/m)
Oxalsäuredihydrat- Lösung 3,5% (m/V) ad us.vet.
– stark saure Reaktion (pH)
– Mischung aus OS- Lösung mit verdünnter Schwefelsäure und Kaliumpermanganat- Lösung entfärbt sich nach Erwärmung
– OS- Lösung plus CaCl2- Lösung ergeben weißen Niederschlag, der sich in verdünnter Salzsäure löst
– Lösen von Resorcin in OS- Lösung, Unterschichten mit Schwefelsäure, bei vorsichtigem Erwärmen entsteht blauer bis blaugrüner Ring
Titration mit NaOH- Lösung nach Zusatz von Phenolphthalein bis zur beginnenden Rotfärbung (HAB)
1ml NaOH = 6,303mg OS- Dihydrat
Soll: 5,23 – 5,79% (m/m)
